| 287.ストルンツ石 Strunzite (ドイツ産) |

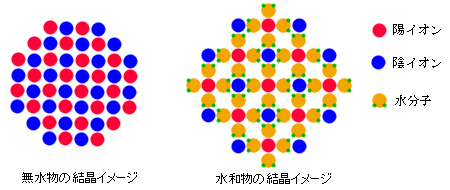
水はすぐれた溶媒で、多くの物質(とくに塩類)を溶かし込むことが出来る。その一方で、溶解され水に取り巻かれた(水和された)イオンは、溶液中に存在する他のイオンとの組み合わせで、つねに最も溶解しにくい結合を作ろうとする。ポートランドセメントや焼石膏が、水を加えることで固まるのはそのためだ。こうして出来た物質は結晶中に水分を含んでいることがある。
また、過飽和水溶液から塩類が晶出するときにも同様のことが起こる。イオンと水との親和力が強いと、水分子をひっつけたまま結晶になるのだ。水を切り離して無水物を作るより、水和物として結晶する方が容易だからで、ミョウバンやたんばん、ほう砂、石膏など多くの塩類が塩水和物を形成する(食塩は違う)。
このとき、イオンを取り巻く水分子の数はたいてい一定で、規則正しい構造が保たれているので、もし加熱などで水を失えば結晶構造も変化する。可能な水和物が複数あるときは、ふつう各水和物が安定に生成する温度領域が存在する。最も水を多く含むものが最低温度で結晶するし、温度が上がれば水を失って別の構造を持った物質に変化する。乾燥した空気中におくだけで、水を失って別種になる鉱物もある。
さて、ストルンツ石はマンガンと鉄の6水和燐酸塩で、美しい麦わら色の放射針状結晶をなす。同様の成分でLaueite(ラウエ石)という8水和塩も存在する。こちらは板状結晶が典型的。いずれもリチオフィル石などから風化によって生じる二次鉱物で、上記の法則を適用すればストルンツ石の方がより高温で生成したとみることが出来よう。ただし、もしストルンツ石の(または同じ結晶構造を持った)タネ結晶が存在せず、一方ラウエ石のタネがあったなら、本来ストルンツ石となるべき条件であっても、出てくるのはラウエ石ばかりだろう(逆もまた真)。鉱物の晶出にはタネと仕掛けが必要なのだ。
ちなみに、沸石類も結晶中に水分を含むが、こちらは水が抜けても構造が変化しない(詳しくはいずれ沸石のページで…)。沸石中の結晶水は「ゼオライト水」とか「沸石水」と呼ばれており、ゼオライト水を持つのは沸石の大きな特徴である。また、やはり高温で生成した水和物は水分が少なく、低温生成のものほど水分が多いという実験則がある。たとえば、ワイラケ沸石Ca(AlSi2O6)2・2H2O、濁沸石Ca(AlSi2O6)2・4H2O、菱沸石Ca(AlSi2O6)2・6H2O は、この順で生成温度が下がってゆくので、同じ産地に見られる時は環境の変化を示す指標と考えることが出来る。
補記:水分子(H2O)は、マイナス電荷をもった大きな酸素(O)の球にプラス電荷をもった小さな水素(H)の球が2コくっついたような形とイメージする。2コの水素は酸素球の一方に偏在しているので、向かい側に相当する酸素の大きな領域はマイナス性を帯びている。それで陽イオンは陰イオンより水分子をひきつけやすい。例えば、マグネシウム、亜鉛、ニッケルなどの陽イオンは水に溶けたとき、まわりに6個の水分子を集める。